Постійна больцмана та її фізичний зміст. Больцмана постійна
Больцман Людвіг (1844-1906)- Великий австрійський фізик, один із основоположників молекулярно-кінетичної теорії. У працях Больцмана молекулярно-кінетична теорія вперше постала як логічно струнка, послідовна фізична теорія. Больцман дав статистичне тлумачення другого закону термодинаміки. Їм багато зроблено у розвиток і популяризації теорії електромагнітного поля Максвелла. Борець за вдачею, Больцман пристрасно обстоював необхідність молекулярного тлумачення теплових явищ і прийняв він основну тяжкість боротьби з вченими, заперечували існування молекул.
До рівняння (4.5.3) входить відношення універсальної газової постійної R до постійної Авогадро N A . Це ставлення однаково всім речовин. Воно називається постійною Больцманом, на честь Л. Больцмана, одного із засновників молекулярно-кінетичної теорії.
Постійна Больцмана дорівнює:
 (4.5.4)
(4.5.4)
Рівняння (4.5.3) з урахуванням постійної Больцмана записується так:
 (4.5.5)
(4.5.5)
Фізичний сенс постійної Больцмана
Історично температура була вперше введена як термодинамічна величина і для неї була встановлена одиниця виміру - градус (див. § 3.2). Після встановлення зв'язку температури із середньою кінетичною енергією молекул стало очевидним, що температуру можна визначати як середню кінетичну енергію молекул і виражати її в джоулях чи ергах, тобто замість величини Тввести величину Т*так, щоб 
Визначена таким чином температура пов'язана з температурою, що виражається в градусах, таким чином:

Тому постійну Больцмана можна розглядати як величину, що зв'язує температуру, що виражається в енергетичних одиницях, із температурою, вираженою в градусах.
Залежність тиску газу від концентрації його молекул та температури
Виразивши Еіз співвідношення (4.5.5) і підставивши у формулу (4.4.10), отримаємо вираз, що показує залежність тиску газу від концентрації молекул і температури:
 (4.5.6)
(4.5.6)
З формули (4.5.6) випливає, що при однакових тисках і температурах концентрація молекул у всіх газів та сама.
Звідси випливає закон Авогадро: у рівних обсягах газів при однакових температурах і тисках міститься однакове число молекул.
Середня кінетична енергія поступального руху молекул прямо пропорційна до абсолютної температури. Коефіцієнт пропорційності- постійну Больцманаk = 10 -23 Дж/К - треба запам'ятати.
§ 4.6. Розподіл максвела
У багатьох випадків знання одних середніх значень фізичних величин недостатньо. Наприклад, знання середнього зростання людей не дозволяє планувати випуск одягу різних розмірів. Потрібно знати приблизну кількість людей, зростання яких лежить у певному інтервалі. Так само важливо знати числа молекул, що мають швидкості, відмінні від середнього значення. Максвелл першим знайшов, як ці цифри можна визначати.
Імовірність випадкової події
У §4.1 ми згадували, що з описи поведінки великої сукупності молекул Дж. Максвелл запровадив поняття ймовірності.
Як неодноразово наголошувалося, у принципі неможливо простежити за зміною швидкості (або імпульсу) однієї молекули протягом великого інтервалу часу. Не можна точно визначити швидкості всіх молекул газу в даний момент часу. З макроскопічних умов, у яких перебуває газ (певний обсяг і температура), не випливають із необхідністю певні значення швидкостей молекул. Швидкість молекули можна розглядати як випадкову величину, яка в даних макроскопічних умовах може приймати різні значення, подібно до того, як при киданні гральної кістки може випасти будь-яке число очок від 1 до 6 (число граней кістки дорівнює шести). Передбачити, скільки очок випаде при даному киданні кістки, не можна. Але ймовірність того, що випаде, скажімо, п'ять очок піддається визначенню.
Що таке ймовірність настання випадкової події? Нехай зроблено дуже велику кількість Nвипробувань (N - Число кидань кістки). При цьому в N" випадках мав місце сприятливий результат випробувань (тобто випадання п'ятірки). Тоді ймовірність цієї події дорівнює відношенню числа випадків зі сприятливим результатом до повного числа випробувань за умови, що це число скільки завгодно велике:
 (4.6.1)
(4.6.1)
Для симетричної кістки ймовірність будь-якого обраного числа очок від 1 до 6 дорівнює.
Ми, що на тлі безлічі випадкових подій виявляється певна кількісна закономірність, з'являється число. Це число – ймовірність – дозволяє обчислювати середні значення. Так, якщо зробити 300 кидань кістки, то середня кількість випадань п'ятірки, як це випливає з формули (4.6.1), дорівнюватиме: 300 ·= 50, причому абсолютно байдуже, кидати 300 разів ту саму кістку або одночасно 300 однакових кісток .
Безсумнівно, що поведінка молекул газу в посудині набагато складніша за рух кинутої гральної кістки. Але й тут можна сподіватися виявити певні кількісні закономірності, що дозволяють обчислювати статистичні середні, якщо ставити завдання так само, як у теорії ігор, а не як у класичній механіці. Потрібно відмовитися від нерозв'язної задачі визначення точного значення швидкості молекули в даний момент і спробувати знайти ймовірність того, що швидкість має певне значення.
(kабо k B)– фізична постійна, що визначає зв'язок між температурою та енергією. Названа на честь австрійського фізика Людвіга Больцмана, який зробив великий внесок у статистичну фізику, в якій ця стала займає ключову позицію. Її експериментальне значення у системі СІ дорівнюєЧисла у круглих дужках вказують стандартну похибку в останніх цифрах значення величини. У принципі, постійну Больцмана можна отримати з визначення абсолютної температури та інших фізичних констант (для цього потрібно вміти розрахувати з перших принципів температуру потрійної точки води). Але визначення постійної Больцмана за допомогою основних принципів надто складне та нереальне при сучасному розвитку знань у цій галузі.
Постійна Больцмана – зайва фізична постійна, якщо вимірювати температуру в одиницях енергії, що часто робиться у фізиці. Вона, власне, зв'язком між добре визначеною величиною – енергією та градусом, значення якого склалося історично.
Визначення ентропії
Ентропія термодинамічної системи визначається як натуральний логарифм від числа різних мікростанів Z, що відповідають даному макроскопічному стану (наприклад, стани із заданою повною енергією).
Коефіцієнт пропорційності kі є постійним Больцманом. Цей вираз, що визначає зв'язок між мікроскопічними (Z) та макроскопічними (S) характеристиками, виражає головну (центральну) ідею статистичної механіки.
Постійна Больцмана (k (\displaystyle k)або k B (\displaystyle k_(\rm (B)))) - фізична постійна, що визначає зв'язок між температурою та енергією. Названа на честь австрійського фізика Людвіга Больцмана, який зробив великий внесок у статистичну фізику, в якій ця стала грає ключову роль. Її значення у Міжнародній системі одиниць СІ відповідно до зміни визначень основних одиниць СІ (2018) точно дорівнює
k = 1,380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\times 10^(-23))Дж/.Зв'язок між температурою та енергією
В однорідному ідеальному газі, що знаходиться за абсолютної температури T (\displaystyle T), енергія, що припадає на кожну поступальну ступінь свободи, дорівнює, як випливає з розподілу Максвелла, k T/2 (\displaystyle kT/2). При кімнатній температурі (300 ) ця енергія становить 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21))Дж, або 0,013 еВ. В одноатомному ідеальному газі кожен атом має три ступені свободи, що відповідають трьом просторовим осям, що означає, що на кожен атом припадає енергія в 3 2 k T (\displaystyle (\frac (3)(2))kT).
Знаючи теплову енергію, можна обчислити середньоквадратичну швидкість атомів, яка обернено пропорційна квадратному кореню атомної маси. Середньоквадратична швидкість за кімнатної температури змінюється від 1370 м/с для гелію до 240 м/с для ксенону. У разі молекулярного газу ситуація ускладнюється, наприклад, двоатомний газ має 5 ступенів свободи - 3 поступальні та 2 обертальні (при низьких температурах, коли не порушені коливання атомів у молекулі і не додаються додаткові ступені свободи).
Визначення ентропії
Ентропія термодинамічної системи визначається як натуральний логарифм від різних мікростанів Z (\displaystyle Z), що відповідають даному макроскопічному стану (наприклад, стану із заданою повною енергією).
S = k ln Z. (\displaystyle S=k\ln Z.)Коефіцієнт пропорційності k (\displaystyle k)і є стала Больцмана. Це вираз, що визначає зв'язок між мікроскопічними ( Z (\displaystyle Z)) та макроскопічними станами ( S (\displaystyle S)), висловлює центральну ідею статистичної механіки.
Народився 1844 року у Відні. Больцман є першопрохідником і першовідкривачем у науці. Його роботи та дослідження часто були незрозумілі та відкинуті суспільством. Проте з подальшим розвитком фізики його праці було визнано та згодом опубліковано.
Наукові інтереси вченого охоплювали такі фундаментальні галузі, як фізика та математика. З 1867 року він працював викладачем у низці вищих навчальних закладів. У своїх дослідженнях він встановив, що обумовлено хаотичними ударами молекул об стінки судини, в якій вони знаходяться, тоді як температура безпосередньо залежить від швидкості руху частинок (молекул), інакше кажучи, від них. Отже, чим з більшою швидкістю рухаються ці частинки, тим вища і температура. Постійну Больцмана названо на честь знаменитого австрійського вченого. Саме він зробив неоціненний внесок у розвиток статичної фізики.
Фізичний зміст цієї постійної величини
Постійна Больцмана визначає зв'язок між такими як температура та енергія. У статичній механіці вона грає головну ключову роль. Постійна Больцмана дорівнює k = 1,3806505 (24) * 10 -23 Дж/К. Числа, що знаходяться у круглих дужках, вказують на допустиму похибку значення величини щодо останніх цифр. Постійна Больцмана також може бути отримана з інших фізичних постійних. Однак ці обчислення досить складні та важкоздійсненні. Вони вимагають глибоких знань у сфері фізики, а й
Згідно із законом Стефана – Больцмана, щільність інтегрального напівсферичного випромінювання. E 0залежить тільки від температури та змінюється пропорційно четвертого ступеня абсолютної температури T:
Стефана – Больцмана постійна σ 0 – фізична постійна, яка входить до закону, що визначає об'ємну щільність рівноважного теплового випромінювання абсолютно чорного тіла:

Історично закон Стефана-Больцмана був сформульований раніше за закон випромінювання Планка, з якого він випливає як наслідок. Закон Планка встановлює залежність спектральної густини потоку випромінювання E 0 від довжини хвилі λ та температури T:

де - довжина хвилі, м; з=2,998 10 8 м/с – швидкість світла у вакуумі; Т- Температура тіла, К;
h= 6,625×10 -34 Дж×с– постійна Планка.
Фізична постійна k, рівна відношенню універсальної газової постійної R=8314Дж/(кг× K) до Авогадро NA=6,022× 10 26 1/(кг× моль):

Число різних конфігурацій системи з Nчастинок для цього набору чисел n i(кількість частинок, що знаходяться в i-тому стані, якому відповідає енергія e i) пропорційно величині:

Величина Wє кількість способів розподілу Nчастинок за енергетичними рівнями. Якщо справедливе співвідношення (6) вважається, що вихідна система підпорядковується статистиці Больцмана. Набір чисел n i, при якому число Wмаксимально, зустрічається найчастіше і найбільш ймовірному розподілу.
Фізична кінетика– мікроскопічна теорія процесів у статистично нерівноважних системах.
Опис великої кількості часток може успішно здійснюватися імовірнісними методами. Для одноатомного газу стан сукупності молекул визначається їх координатами та значеннями проекцій швидкостей відповідні координатні осі. Математично це описується функцією розподілу, що характеризує можливість перебування частки в даному стані:

є очікуване число молекул в обсязі d d , координати яких знаходяться в інтервалі від + d , а швидкості в інтервалі від + d.
Якщо середньою за часом потенційною енергією взаємодії молекул можна знехтувати порівняно з їхньою кінетичною енергією, то газ називається ідеальним. Ідеальний газ називається газом Больцмана, якщо відношення довжини пробігу молекул у цьому газі до характерного розміру течії Lзвісно, тобто.

т.к. довжина пробігу обернено пропорційна nd 2(n – числова щільність 1/м 3 , d – діаметр молекули, м).
Величину
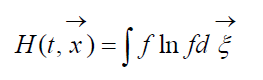
називають H-функцією Больцмана для одиниці об'єму, яка пов'язана з ймовірністю виявлення системи молекул газу в даному стані. Кожному стану відповідають певні числа заповнення шестивимірних просторово-швидкісних осередків, на які може бути розбитий фазовий простір молекул, що розглядаються. Позначимо Wймовірність того, що в першому осередку розглянутого простору виявиться N 1 молекул, у другому N 2 і т.д.
З точністю до постійної, що визначає початок відліку ймовірності, правомірне співвідношення:
 ,
,
де  – H-функція області простору А, зайнятий газом. З (9) видно, що Wі Hвзаємопов'язані, тобто. Зміна ймовірності стану призводить до відповідної еволюції H функції.
– H-функція області простору А, зайнятий газом. З (9) видно, що Wі Hвзаємопов'язані, тобто. Зміна ймовірності стану призводить до відповідної еволюції H функції.

Больцмана принцип встановлює зв'язок між ентропією Sфізичної системи та термодинамічної ймовірністю Wїї стану:

(друкується за виданням: Коган М.Н. Динаміка розрідженого газу. - М.: Наука, 1967)
Загальний вигляд КУБ:

де – масова сила, обумовлена наявністю різних полів (гравітаційного, електричного, магнітного), що діє молекулу; J- Інтеграл зіткнень. Саме цей член рівняння Больцмана враховує зіткнення молекул одна з одною та відповідні зміни швидкостей взаємодіючих частинок. Інтеграл зіткнень є п'ятивимірним інтегралом і має наступну структуру:

Рівняння (12) з інтегралом (13) отримано зіткнення молекул, у яких немає тангенціальних сил, тобто. частинки, що стикаються, вважаються ідеально гладкими.
У процесі взаємодії внутрішня енергія молекул змінюється, тобто. передбачається, що ці молекули є ідеально пружними. Розглядаються дві групи молекул, що мають до зіткнення одна з одною (зіткнення) швидкості та (рис. 1), а після зіткнення відповідно швидкості та . Різниця швидкостей і називається відносною швидкістю, тобто. . Зрозуміло, що для гладкого пружного зіткнення. Функції розподілу f 1 ", f", f 1, fописують молекули відповідних груп після до зіткнень, тобто. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Мал. 1. Зіткнення двох молекул.
У (13) входять два параметри, що характеризують розташування стикаються молекул один щодо одного: bта ε; b– прицільна відстань, тобто. найменша відстань, на яку зблизилися б молекули за відсутності взаємодії (рис. 2); ε називають кутовим параметром зіткнень (рис. 3). Інтегрування по bвід 0 до ¥ і по від 0 до 2p (два зовнішні інтеграли (12)) охоплює всю площину силової взаємодії перпендикулярно вектору

Мал. 2. Траєкторія руху молекул.

Мал. 3. Розгляд взаємодії молекул у циліндричній системі координат: z, b, ε
Кінетичне рівняння Больцмана виведено за таких припущень і припущень.
1. Вважається, що відбувається переважно зіткнення двох молекул, тобто. роль зіткнень одночасно трьох і більшої кількості молекул незначна. Це припущення дозволяє використовувати для аналізу одночасткову функцію розподілу, яка названа вище просто функцією розподілу. Врахування зіткнення трьох молекул призводить до необхідності використання в дослідженні двочастинної функції розподілу. Відповідно аналіз суттєво ускладнюється.
2. Припущення про молекулярний хаос. Воно виявляється у тому, що ймовірності виявлення частки 1 у фазовій точці та частинки 2 у фазовій точці незалежні один від одного.
3. Рівноймовірні зіткнення молекул з будь-якою прицільною відстанню, тобто. функція розподілу не змінюється діаметрі взаємодії. Необхідно відзначити, що аналізований елемент має бути малим, щоб fв межах цього елемента не змінювалася, але в той же час, щоб не була велика відносна флуктуація ~ . Потенціали взаємодії, використовувані під час обчислення інтеграла зіткнень, є сферично симетричними, тобто. ![]() .
.
Розподіл Максвелла-Больцмана
Рівноважний стан газу описується абсолютним Максвеллівським розподілом, який є точним рішенням кінетичного рівняння Больцмана:

де m - Маса молекули, кг.
Загальний локально-максвеллівський розподіл інакше званий розподіл Максвелла-Больцмана:

у тому випадку, коли газ рухається як ціле зі швидкістю і змінні n , T залежать від координати
та часу t.
У полі тяжіння Землі точне рішення рівняння Больцмана показує:

де n 0 = щільність біля Землі, 1/м 3 ; g- Прискорення сили тяжіння, м / с 2; h- Висота, м. Формула (16) є точним рішенням кінетичного рівняння Больцман або в безмежному просторі, або за наявності кордонів, що не порушують цього розподілу, при цьому температура також повинна залишатися постійною.
Ця сторінка оформлена Пузіною Ю.Ю. за підтримки Російського Фонду Фундаментальних досліджень – проект №08-08-00638.
 Урок-дослідження "Морфологія
Урок-дослідження "Морфологія Російська церковнослов'янська словник онлайн
Російська церковнослов'янська словник онлайн Перелік операцій вручну 1 з 8
Перелік операцій вручну 1 з 8