Bolcmana konstante un tās fiziskā nozīme. Bolcmana konstante
Bolcmans Ludvigs (1844-1906)- izcils austriešu fiziķis, viens no molekulārās kinētiskās teorijas pamatlicējiem. Boltzmana darbos molekulārā kinētiskā teorija vispirms parādījās kā loģiski saskaņota, konsekventa fizikālā teorija. Bolcmans sniedza termodinamikas otrā likuma statistisku interpretāciju. Viņš daudz darīja, lai attīstītu un popularizētu Maksvela elektromagnētiskā lauka teoriju. Pēc dabas būdams cīnītājs, Bolcmans kaislīgi aizstāvēja vajadzību pēc termisko parādību molekulārās interpretācijas un cieta cīņu pret zinātniekiem, kuri noliedza molekulu esamību.
Vienādojums (4.5.3.) ietver universālās gāzes konstantes attiecību R uz Avogadro konstanti N A . Šī attiecība ir vienāda visām vielām. To sauc par Bolcmaņa konstanti, par godu L. Bolcmanam, vienam no molekulārās kinētiskās teorijas pamatlicējiem.
Bolcmaņa konstante ir:
 (4.5.4)
(4.5.4)
Vienādojumu (4.5.3.), ņemot vērā Bolcmana konstanti, raksta šādi:
 (4.5.5)
(4.5.5)
Bolcmaņa konstantes fiziskā nozīme
Vēsturiski temperatūra vispirms tika ieviesta kā termodinamiskais lielums, un tika noteikta tās mērvienība - grādi (sk. § 3.2). Noskaidrojot saikni starp temperatūru un molekulu vidējo kinētisko enerģiju, kļuva skaidrs, ka temperatūru var definēt kā molekulu vidējo kinētisko enerģiju un izteikt džoulos vai ergos, t.i., daudzuma vietā. T ievadiet vērtību T* tātad 
Šādi definētā temperatūra ir saistīta ar temperatūru, kas izteikta grādos šādi:

Tāpēc Bolcmaņa konstanti var uzskatīt par lielumu, kas saista temperatūru, kas izteikta enerģijas vienībās, ar temperatūru, kas izteikta grādos.
Gāzes spiediena atkarība no tās molekulu koncentrācijas un temperatūras
Izteicis E no attiecības (4.5.5) un aizvietojot formulā (4.4.10), iegūstam izteiksmi, kas parāda gāzes spiediena atkarību no molekulu koncentrācijas un temperatūras:
 (4.5.6)
(4.5.6)
No formulas (4.5.6.) izriet, ka vienādos spiedienos un temperatūrās molekulu koncentrācija visās gāzēs ir vienāda.
Tas nozīmē Avogadro likumu: vienādos daudzumos gāzu vienādās temperatūrās un spiedienā ir vienāds skaits molekulu.
Molekulu translācijas kustības vidējā kinētiskā enerģija ir tieši proporcionāla absolūtajai temperatūrai. Proporcionalitātes faktors- Bolcmana konstantek = 10 -23 J/K - vajag atcerēties.
§ 4.6. Maksvela sadalījums
Daudzos gadījumos ar zināšanām par fizisko lielumu vidējām vērtībām vien nepietiek. Piemēram, cilvēku vidējā auguma pārzināšana neļauj plānot apģērbu ražošanu dažādos izmēros. Jums jāzina aptuvenais cilvēku skaits, kuru augums atrodas noteiktā intervālā. Tāpat ir svarīgi zināt molekulu skaitu, kuru ātrums atšķiras no vidējās vērtības. Maksvels bija pirmais, kurš atklāja, kā šos skaitļus var noteikt.
Nejauša notikuma varbūtība
§4.1 mēs jau minējām, ka, lai aprakstītu lielas molekulu kolekcijas uzvedību, J. Maksvels ieviesa varbūtības jēdzienu.
Kā jau vairākkārt uzsvērts, principā nav iespējams uzraudzīt vienas molekulas ātruma (vai impulsa) izmaiņas lielā laika periodā. Tāpat nav iespējams precīzi noteikt visu gāzes molekulu ātrumu noteiktā laikā. No makroskopiskajiem apstākļiem, kādos atrodas gāze (noteikts tilpums un temperatūra), noteiktas molekulāro ātrumu vērtības ne vienmēr izriet. Molekulas ātrumu var uzskatīt par nejaušu lielumu, kas dotajos makroskopiskos apstākļos var iegūt dažādas vērtības, tāpat kā metot kauli, var parādīties jebkurš punktu skaits no 1 līdz 6 (metiņa malu skaits ir seši). Nav iespējams paredzēt punktu skaitu, kas iegūs, metot kauliņu. Bet varbūtība ripināt, teiksim, piecus punktus ir nosakāma.
Kāda ir nejauša notikuma iespējamība? Lai tiek ražots ļoti liels skaits N testiem (N - kauliņu metienu skaits). Tajā pašā laikā, iekšā N" gadījumos bija labvēlīgs pārbaužu iznākums (t.i., kritums piecinieks). Tad konkrētā notikuma varbūtība ir vienāda ar labvēlīga iznākuma gadījumu skaita attiecību pret kopējo izmēģinājumu skaitu, ja šis skaits ir tik liels, cik vēlams:
 (4.6.1)
(4.6.1)
Simetriskam kauliņam jebkura izvēlētā punktu skaita no 1 līdz 6 varbūtība ir .
Mēs redzam, ka uz daudzu nejaušu notikumu fona atklājas noteikts kvantitatīvs modelis, parādās skaitlis. Šis skaitlis - varbūtība - ļauj aprēķināt vidējos rādītājus. Tātad, ja tu met 300 kauliņus, tad vidējais piecinieku skaits, kā izriet no formulas (4.6.1), būs vienāds ar: 300 = 50, un nav absolūti nekādas atšķirības, vai tu met vienu un to pašu kauliņu 300 vai 300. identiski kauliņi tajā pašā laikā.
Nav šaubu, ka gāzes molekulu uzvedība traukā ir daudz sarežģītāka nekā izmesto kauliņu kustība. Bet arī šeit var cerēt atklāt noteiktus kvantitatīvus modeļus, kas ļauj aprēķināt vidējos statistiskos rādītājus, ja vien problēma tiek izvirzīta tāpat kā spēļu teorijā, nevis kā klasiskajā mehānikā. Ir jāatsakās no neatrisināmās problēmas, proti, noteikt precīzu molekulas ātruma vērtību dotajā brīdī un mēģināt atrast varbūtību, ka ātrumam ir noteikta vērtība.
(k vai k B) ir fizikāla konstante, kas nosaka attiecības starp temperatūru un enerģiju. Nosaukts pēc austriešu fiziķa Ludviga Bolcmaņa, kurš sniedza lielu ieguldījumu statistiskajā fizikā, kurā šī kļuva par galveno amatu. Tā eksperimentālā vērtība SI sistēmā irCipari iekavās norāda standarta kļūdu daudzuma vērtības pēdējos ciparus. Principā Bolcmaņa konstanti var iegūt no absolūtās temperatūras definīcijas un citām fizikālajām konstantēm (lai to izdarītu, jums ir jāspēj aprēķināt ūdens trīskāršā punkta temperatūru no pirmajiem principiem). Taču Bolcmana konstantes noteikšana, izmantojot pirmos principus, ir pārāk sarežģīta un nereāla, ņemot vērā pašreizējo zināšanu attīstību šajā jomā.
Boltzmana konstante ir lieka fizikālā konstante, ja temperatūru mēra enerģijas vienībās, ko ļoti bieži dara fizikā. Tā patiesībā ir saikne starp precīzi definētu lielumu – enerģiju un pakāpi, kuras nozīme ir veidojusies vēsturiski.
Entropijas definīcija
Termodinamiskās sistēmas entropiju definē kā dažādu mikrostāvokļu Z skaita naturālo logaritmu, kas atbilst noteiktam makroskopiskajam stāvoklim (piemēram, stāvokļiem ar noteiktu kopējo enerģiju).
Proporcionalitātes faktors k un ir Bolcmaņa konstante. Šī izteiksme, kas nosaka attiecības starp mikroskopiskām (Z) un makroskopiskām (S) īpašībām, izsaka galveno (centrālo) statistikas mehānikas ideju.
Bolcmana konstante (k (\displaystyle k) vai k B (\displaystyle k_(\rm (B)))) - fizikālā konstante, kas nosaka attiecības starp temperatūru un enerģiju. Nosaukts pēc austriešu fiziķa Ludviga Bolcmaņa, kurš sniedza lielu ieguldījumu statistiskajā fizikā, kurā šai konstantei ir galvenā loma. Tās vērtība Starptautiskajā vienību sistēmā SI atbilstoši izmaiņām SI pamatvienību definīcijās (2018. gads) ir tieši vienāda ar
k = 1,380 649 × 10–23 (\displeja stils k=1(,)380\,649\reizes 10^(-23)) J/.Temperatūras un enerģijas saistība
Viendabīgā ideālā gāzē absolūtā temperatūrā T (\displaystyle T), enerģija uz katru translācijas brīvības pakāpi ir vienāda, kā izriet no Maksvela sadalījuma, k T / 2 (\displaystyle kT/2). Istabas temperatūrā (300 ) šī enerģija ir 2 , 07 × 10 - 21 (\displaystyle 2(,)07\times 10^(-21)) J vai 0,013 eV. Monatomiskā ideālā gāzē katram atomam ir trīs brīvības pakāpes, kas atbilst trim telpiskajām asīm, kas nozīmē, ka katra atoma enerģija ir 3 2 k T (\displaystyle (\frac (3) (2)) kT).
Zinot siltumenerģiju, mēs varam aprēķināt atomu vidējo kvadrātisko ātrumu, kas ir apgriezti proporcionāls atomu masas kvadrātsaknei. Vidējais kvadrātiskais ātrums istabas temperatūrā svārstās no 1370 m/s hēlijam līdz 240 m/s ksenonam. Molekulārās gāzes gadījumā situācija kļūst sarežģītāka, piemēram, divatomu gāzei ir 5 brīvības pakāpes - 3 translācijas un 2 rotācijas (zemā temperatūrā, kad netiek ierosinātas atomu vibrācijas molekulā un papildu pakāpes brīvība netiek pievienota).
Entropijas definīcija
Termodinamiskās sistēmas entropija tiek definēta kā dažādu mikrostāvokļu skaita dabiskais logaritms Z (\displaystyle Z), kas atbilst noteiktam makroskopiskam stāvoklim (piemēram, stāvoklim ar noteiktu kopējo enerģiju).
S = k ln Z . (\displaystyle S=k\ln Z.)Proporcionalitātes faktors k (\displaystyle k) un ir Bolcmaņa konstante. Šī ir izteiksme, kas definē attiecības starp mikroskopiskām ( Z (\displaystyle Z)) un makroskopiskie stāvokļi ( S (\displaystyle S)), pauž statistikas mehānikas galveno ideju.
Dzimis 1844. gadā Vīnē. Bolcmans ir zinātnes pionieris un pionieris. Viņa darbi un pētījumi bieži bija sabiedrībai nesaprotami un noraidīti. Tomēr līdz ar fizikas tālāku attīstību viņa darbi tika atzīti un pēc tam publicēti.
Zinātnieka zinātniskās intereses aptvēra tādas fundamentālas jomas kā fizika un matemātika. Kopš 1867. gada viņš strādāja par skolotāju vairākās augstākās izglītības iestādēs. Savā pētījumā viņš konstatēja, ka tas ir saistīts ar molekulu haotisku ietekmi uz trauka sienām, kurā tās atrodas, savukārt temperatūra ir tieši atkarīga no daļiņu (molekulu) kustības ātruma, citiem vārdiem sakot, no to. Tāpēc, jo lielāks ir šo daļiņu kustības ātrums, jo augstāka ir temperatūra. Boltzmana konstante ir nosaukta slavenā austriešu zinātnieka vārdā. Tas bija viņš, kurš sniedza nenovērtējamu ieguldījumu statiskās fizikas attīstībā.
Šī nemainīgā daudzuma fiziskā nozīme
Boltzmana konstante nosaka attiecības starp temperatūru un enerģiju. Statiskajā mehānikā tai ir galvenā loma. Bolcmana konstante ir vienāda ar k=1,3806505(24)*10 -23 J/K. Cipari iekavās norāda vērtības pieļaujamo kļūdu attiecībā pret pēdējiem cipariem. Ir vērts atzīmēt, ka Bolcmana konstanti var iegūt arī no citām fizikālajām konstantēm. Tomēr šie aprēķini ir diezgan sarežģīti un grūti izpildāmi. Tās prasa dziļas zināšanas ne tikai fizikas jomā, bet arī
Saskaņā ar Stefana-Bolcmaņa likumu integrālā puslodes starojuma blīvums E 0 ir atkarīgs tikai no temperatūras un mainās proporcionāli absolūtās temperatūras ceturtajai pakāpei T:
Stefana–Bolcmaņa konstante σ 0 ir likumā iekļauta fizikālā konstante, kas nosaka absolūti melna ķermeņa līdzsvara termiskā starojuma tilpuma blīvumu:

Vēsturiski Stefana-Bolcmaņa likums tika formulēts pirms Planka radiācijas likuma, no kura tas izriet kā sekas. Planka likums nosaka starojuma spektrālās plūsmas blīvuma atkarību E 0 uz viļņa garuma λ un temperatūru T:

kur λ – viļņa garums, m; Ar=2,998 10 8 m/s – gaismas ātrums vakuumā; T– ķermeņa temperatūra, K;
h= 6,625 × 10 -34 J × s – Planka konstante.
Fiziskā konstante k, vienāds ar universālās gāzes konstantes attiecību R=8314J/(kg×K) līdz Avogadro numuram N.A.=6,022 × 10 26 1/(kg × mol):

Dažādu sistēmas konfigurāciju skaits no N daļiņas noteiktai skaitļu kopai n i(daļiņu skaits i-stāvoklis, kuram atbilst enerģija e i) ir proporcionāls vērtībai:

Lielums W ir vairāki izplatīšanas veidi N daļiņas pēc enerģijas līmeņiem. Ja sakarība (6) ir patiesa, tad tiek uzskatīts, ka sākotnējā sistēma pakļaujas Bolcmana statistikai. Ciparu kopa n i, pie kura numurs W maksimums, notiek visbiežāk un atbilst visticamākajam sadalījumam.
Fizikālā kinētika– procesu mikroskopiskā teorija statistiski nelīdzsvarotās sistēmās.
Liela skaita daļiņu aprakstu var veiksmīgi veikt, izmantojot varbūtības metodes. Monatomiskajai gāzei molekulu kopas stāvokli nosaka to koordinātas un ātruma projekciju vērtības uz attiecīgajām koordinātu asīm. Matemātiski to raksturo sadalījuma funkcija, kas raksturo varbūtību, ka daļiņa atrodas noteiktā stāvoklī:

ir paredzamais molekulu skaits tilpumā d d, kuru koordinātas ir diapazonā no līdz +d un kuru ātrums ir diapazonā no līdz +d.
Ja molekulu mijiedarbības laika vidējo potenciālo enerģiju var neņemt vērā salīdzinājumā ar to kinētisko enerģiju, tad gāzi sauc par ideālu. Ideālu gāzi sauc par Bolcmaņa gāzi, ja šajā gāzē esošo molekulu ceļa garuma attiecība pret plūsmas raksturīgo lielumu. L protams, t.i.

jo ceļa garums ir apgriezti proporcionāls un 2(n ir skaitliskais blīvums 1/m 3, d ir molekulas diametrs, m).
Izmērs
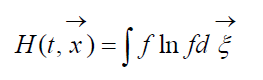
sauca H-Boltzmana funkcija tilpuma vienībai, kas saistīta ar gāzes molekulu sistēmas noteikšanas varbūtību noteiktā stāvoklī. Katrs stāvoklis atbilst noteiktam skaitam aizpildošu sešdimensiju telpas ātruma šūnu, kurās var sadalīt aplūkojamo molekulu fāzu telpu. Apzīmēsim W varbūtība, ka aplūkojamās telpas pirmajā šūnā būs N 1 molekulas, otrajā - N 2 utt.
Līdz konstantei, kas nosaka varbūtības izcelsmi, ir spēkā šāda sakarība:
 ,
,
Kur  – telpas apgabala H funkcija A aizņem gāze. No (9) ir skaidrs, ka W Un H savstarpēji saistīti, t.i. stāvokļa iespējamības izmaiņas noved pie atbilstošas H funkcijas evolūcijas.
– telpas apgabala H funkcija A aizņem gāze. No (9) ir skaidrs, ka W Un H savstarpēji saistīti, t.i. stāvokļa iespējamības izmaiņas noved pie atbilstošas H funkcijas evolūcijas.

Bolcmana princips nosaka saikni starp entropiju S fizikālā sistēma un termodinamiskā varbūtība W viņa norāda:

(publicēts pēc publikācijas: Kogans M.N. Retinātas gāzes dinamika. - M.: Nauka, 1967.)
CUBE vispārīgs skats:

kur ir masas spēks, ko rada dažādu lauku (gravitācijas, elektrisko, magnētisko) klātbūtne, kas iedarbojas uz molekulu; Dž– sadursmes integrālis. Tieši šis Bolcmana vienādojuma termins ņem vērā molekulu sadursmes savā starpā un atbilstošās mijiedarbības daļiņu ātruma izmaiņas. Sadursmes integrālis ir piecdimensiju integrālis, un tam ir šāda struktūra:

Vienādojums (12) ar integrāli (13) tika iegūts molekulu sadursmēm, kurās nerodas tangenciālie spēki, t.i. sadursmes daļiņas tiek uzskatītas par pilnīgi gludām.
Mijiedarbības laikā molekulu iekšējā enerģija nemainās, t.i. tiek pieņemts, ka šīs molekulas ir pilnīgi elastīgas. Aplūkojam divas molekulu grupas, kurām ir ātrumi un pirms sadursmes savā starpā (1. att.), un pēc sadursmes attiecīgi ātrumi un . Ātruma starpību sauc par relatīvo ātrumu, t.i. . Skaidrs, ka gludai elastīgai sadursmei . Sadales funkcijas f 1 ", f", f 1 , f apraksta atbilstošo grupu molekulas pēc un pirms sadursmēm, t.i. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Rīsi. 1. Divu molekulu sadursme.
(13) ietver divus parametrus, kas raksturo sadursmes molekulu atrašanās vietu attiecībā pret otru: b un ε; b– mērķēšanas attālums, t.i. mazākais attālums, kuram molekulas tuvotos, ja nebūtu mijiedarbības (2. att.); ε sauc par sadursmes leņķa parametru (3. att.). Integrācija beigusies b no 0 līdz ¥ un no 0 līdz 2p (divi ārējie integrāļi (12)) aptver visu spēka mijiedarbības plakni, kas ir perpendikulāra vektoram

Rīsi. 2. Molekulu kustības trajektorija.

Rīsi. 3. Molekulu mijiedarbības apsvēršana cilindriskā koordinātu sistēmā: z, b, ε
Boltzmana kinētiskais vienādojums ir iegūts saskaņā ar šādiem pieņēmumiem un pieņēmumiem.
1. Tiek uzskatīts, ka galvenokārt notiek divu molekulu sadursmes, t.i. trīs vai vairāku molekulu sadursmju loma vienlaikus ir nenozīmīga. Šis pieņēmums ļauj analīzei izmantot vienas daļiņas sadalījuma funkciju, ko iepriekš vienkārši sauc par sadalījuma funkciju. Ņemot vērā trīs molekulu sadursmi, pētījumā ir jāizmanto divu daļiņu sadalījuma funkcija. Attiecīgi analīze kļūst ievērojami sarežģītāka.
2. Molekulārā haosa pieņēmums. To izsaka fakts, ka varbūtības noteikt daļiņu 1 fāzes punktā un daļiņu 2 fāzes punktā ir neatkarīgas viena no otras.
3. Vienlīdz iespējamas ir molekulu sadursmes ar jebkuru trieciena attālumu, t.i. sadalījuma funkcija pie mijiedarbības diametra nemainās. Jāņem vērā, ka analizējamajam elementam jābūt mazam, lai fšī elementa ietvaros nemainās, bet tajā pašā laikā tā, lai relatīvā svārstība ~ nebūtu liela. Sadursmes integrāļa aprēķinā izmantotie mijiedarbības potenciāli ir sfēriski simetriski, t.i. ![]() .
.
Maxwell-Boltzmann sadalījums
Gāzes līdzsvara stāvokli raksturo absolūtais Maksvela sadalījums, kas ir precīzs Bolcmana kinētiskā vienādojuma risinājums:

kur m ir molekulas masa, kg.
Vispārējais lokālais Maksvela sadalījums, citādi saukts par Maksvela-Bolcmaņa sadalījumu:

gadījumā, ja gāze kustas kopumā ar ātrumu un mainīgie n, T ir atkarīgi no koordinātas
un laiks t.
Zemes gravitācijas laukā precīzs Bolcmana vienādojuma risinājums parāda:

Kur n 0 = blīvums uz Zemes virsmas, 1/m3; g– gravitācijas paātrinājums, m/s 2 ; h– augstums, m Formula (16) ir precīzs Bolcmaņa kinētiskā vienādojuma risinājums vai nu neierobežotā telpā, vai arī robežu klātbūtnē, kas nepārkāpj šo sadalījumu, turklāt temperatūrai ir jāpaliek nemainīgai.
Šo lapu izstrādāja Puzina Yu.Yu. ar Krievijas Fundamentālo pētījumu fonda atbalstu - projekta Nr.08-08-00638.
 Aleksandra Humbolta darbi
Aleksandra Humbolta darbi Makara Dmitrijeviča vārda nozīme
Makara Dmitrijeviča vārda nozīme Kā aizpildīt atskaiti par saņemto līdzekļu paredzēto izlietojumu
Kā aizpildīt atskaiti par saņemto līdzekļu paredzēto izlietojumu